Cancer Cell最新综述:CAR-T治疗实体瘤,任重道远,但未来可期!
作者及单位:邦耀生物联合华东师范大学️刘明耀教授、️杜冰教授
不同于血液肿瘤的成功,CART在实体瘤治疗中面临诸多挑战,包括肿瘤抗原的异质性、肿瘤微环境的免疫抑制性等。学习杜冰教授等前两天在Cancer Cell发表的一篇综述,里面详细讨论了CAR-T细胞疗法在实体瘤治疗中的临床研究进展、面临的挑战以及潜在的改进策略,强调了CAR-T细胞疗法在实体瘤治疗中的潜力,并提出了多种策略来克服当前的障碍。
️主要内容
️1、目前正在进行的嵌合抗原受体T细胞在实体瘤中的临床试验
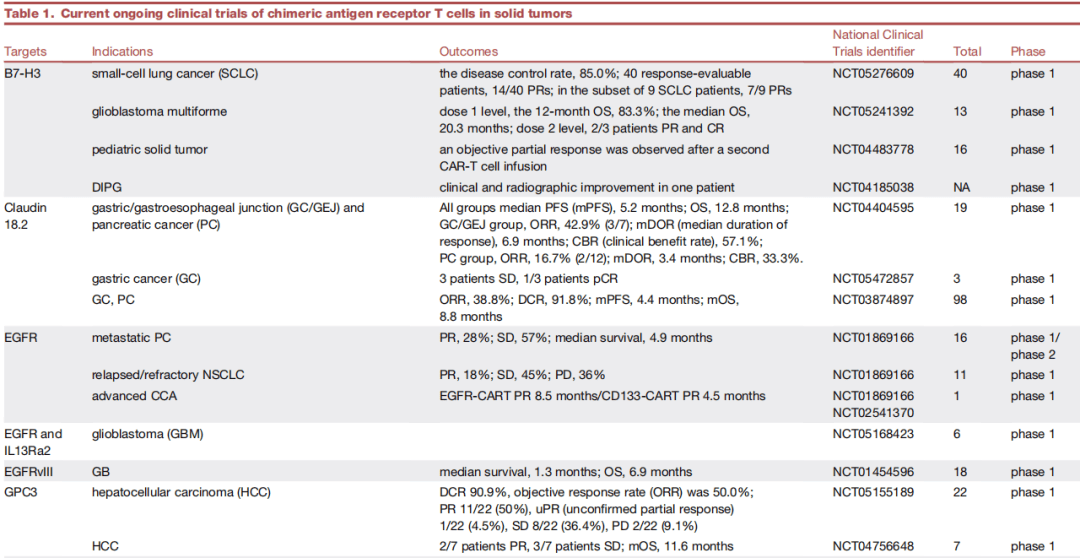
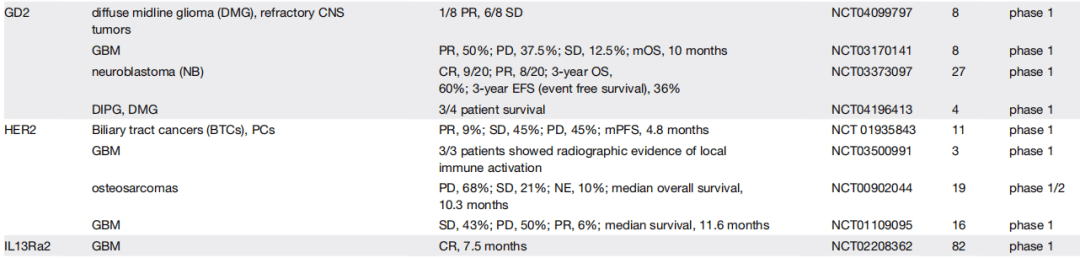
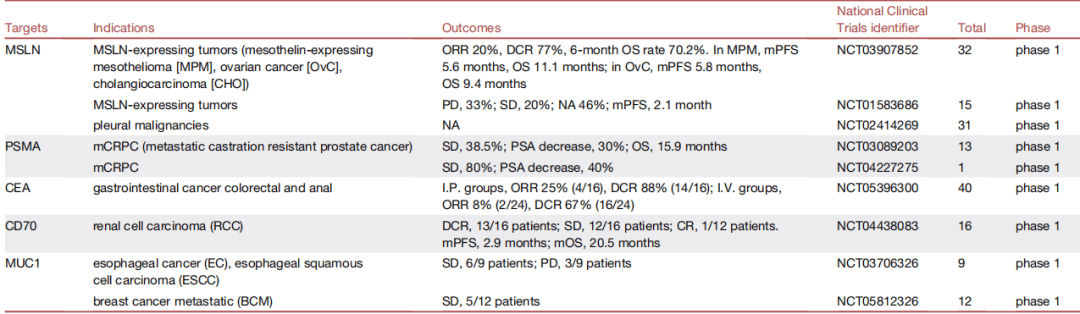
包括各个靶点在不同适应症的临床结果,如B7H3靶向CART:
️小细胞肺癌(SCLC):
疾病控制率(DCR)为85.0%,40例可评估患者中14例部分缓解(PR),9例SCLC患者中7例PR(NCT05276609,40例,I期)。
️胶质母细胞瘤(GBM):
dose1,12个月总生存率(OS)为83.3%,中位OS为20.3个月;
dose2,3例患者中2例PR和1例CR(NCT05241392,13例,I期)。
️儿童实体瘤:
第二次CAR-T细胞输注后观察到部分缓解(NCT04483778,16例,I期)。
️弥漫性内生型脑桥胶质瘤(DIPG):
1例患者临床和影像学改善(NCT04185038,NA,I期)。
收藏,具体各GD2、Claudin18.2靶向等CART的临床疗效详见表格。
️2、CART在实体瘤中的挑战
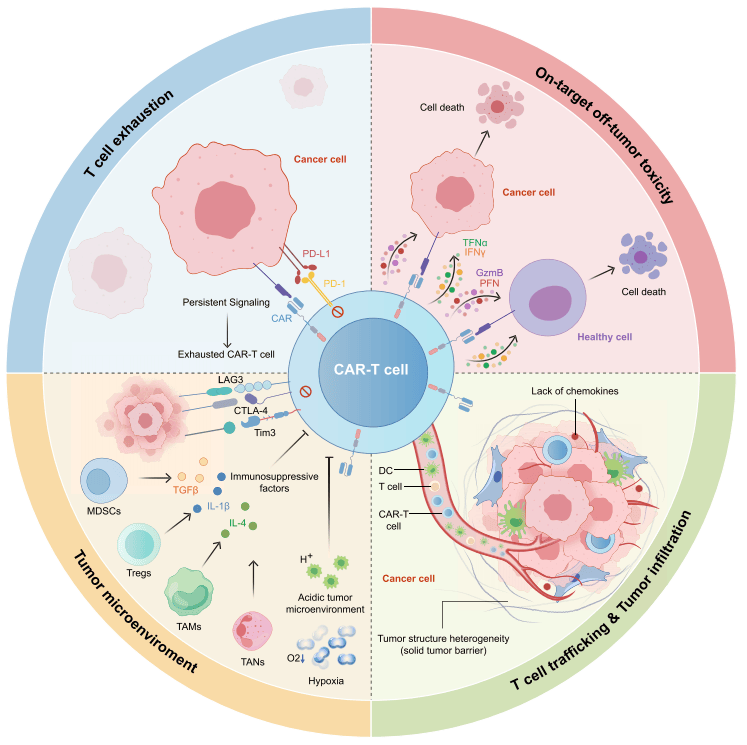
️肿瘤抗原的异质性:
实体瘤细胞的抗原表达存在显著的异质性,这意味着即使在同一个肿瘤中,不同癌细胞也可能表达不同的抗原。这种异质性使得CAR-T细胞难以有效识别和攻击所有癌细胞,增加了治疗的复杂性。
️靶向抗原的非肿瘤特异性:
CAR-T细胞的靶向抗原可能不仅存在于肿瘤细胞上,也可能在正常组织中表达。这种on-target, off-tumor toxicity可能导致严重的副作用,限制了CAR-T细胞疗法的安全性和有效性。
️T细胞浸润不足和持久性差:
与血液系统恶性肿瘤不同,实体瘤的肿瘤微环境通常具有免疫抑制性,这会阻碍CAR-T细胞的浸润和持久性。T细胞需要能够有效地穿透肿瘤组织并在其中长期存活,才能发挥抗肿瘤作用。
️免疫抑制性肿瘤微环境:
实体瘤的肿瘤微环境通常包含多种免疫抑制性细胞和分子,如调节性T细胞(Tregs)、髓源性抑制细胞(MDSCs)和免疫抑制性细胞因子(如TGF-β和IL-10)。这些因素共同作用,抑制了CAR-T细胞的活性和功能。
️T细胞耗竭:
CAR-T细胞在持续暴露于肿瘤抗原后容易发生耗竭,表现为功能下降、增殖能力减弱和存活时间缩短。T细胞耗竭是CAR-T细胞疗法在实体瘤治疗中面临的一个重要问题,因为它显著削弱了CAR-T细胞的抗肿瘤效果。
️3、克服实体瘤障碍的策略
️1. 优化CAR结构
- ️新型CAR设计:包括E-CAR、STAR-CAR和CAR-Toner等新一代CAR结构,这些设计旨在提高CAR-T细胞的疗效和安全性,特别是在实体瘤治疗中。
- ️减少tonic signaling(持续信号):通过修改CAR的胞外结构域、替换共刺激结构域或调节下游信号传导(如引入CD3ε细胞质结构域),减少因持续信号导致的T细胞耗竭。
️2. 增强T细胞功能
- ️过表达转录因子:如FOXO1和c-Jun,这些转录因子能够增强CAR-T细胞的记忆表型和抗耗竭能力,从而提高其在实体瘤中的持久性和抗肿瘤活性。
- ️代谢重编程:通过过表达特定基因(如IL-4、IL-10、IL-15)或敲除抑制代谢的基因(如REGNASE-1、RASA2),增强CAR-T细胞的代谢适应性和功能。
- ️免疫检查点抑制:通过敲除或阻断免疫检查点分子(如BTLA、A2AR),增强CAR-T细胞的活性和抗肿瘤能力。
️3. 调控肿瘤微环境TME
- ️趋化因子修饰:通过在CAR-T细胞中表达趋化因子(如CXCR2/4、IL-7、CCL19),增强CAR-T细胞向肿瘤组织的浸润能力。
- ️基质降解:通过表达酶(如heparanase)降解肿瘤基质,改善CAR-T细胞在肿瘤组织中的渗透。
- ️免疫检查点抑制剂联合使用:与PD-1/PD-L1抑制剂联合使用,增强CAR-T细胞在免疫抑制性肿瘤微环境中的活性。
️4. 提高CAR-T细胞疗法的安全性
- ️自杀开关:如诱导型caspase-9基因,用于控制CAR-T细胞的过度反应,减少副作用。
- ️逻辑门控CAR-T细胞:通过设计AND门控CAR-T细胞,实现更高的肿瘤特异性和减少非肿瘤毒性。
- ️pH敏感CAR-T细胞:开发在酸性肿瘤微环境中特异性激活的CAR-T细胞,以减少对正常组织的毒性。
️5. 创新的CAR-T细胞制造方法
- ️非病毒基因编辑:利用CRISPR-Cas9等基因编辑技术,精确地将CAR基因插入T细胞基因组的特定位置,提高CAR-T细胞的稳定性和安全性。
- ️异体CAR-T细胞:开发“现成可用”的异体CAR-T细胞产品,减少制造成本和时间,同时提高治疗的可及性。
️6. 联合治疗策略
- ️与化疗、放疗和手术结合:通过与传统治疗方法联合使用,增强CAR-T细胞疗法的疗效。
- ️mRNA疫苗联合使用:通过mRNA疫苗激活和扩增CAR-T细胞,增强其抗肿瘤能力。
这些策略强调了通过多学科的整合和创新,可以显著提高CAR-T细胞疗法在实体瘤治疗中的效果和安全性。这些策略不仅针对CAR-T细胞本身的优化,还包括对肿瘤微环境的调控和联合治疗的探索,为未来CAR-T细胞疗法的发展提供了新的方向。
️4、基因敲除或过表达增强CAR-T细胞功能的策略
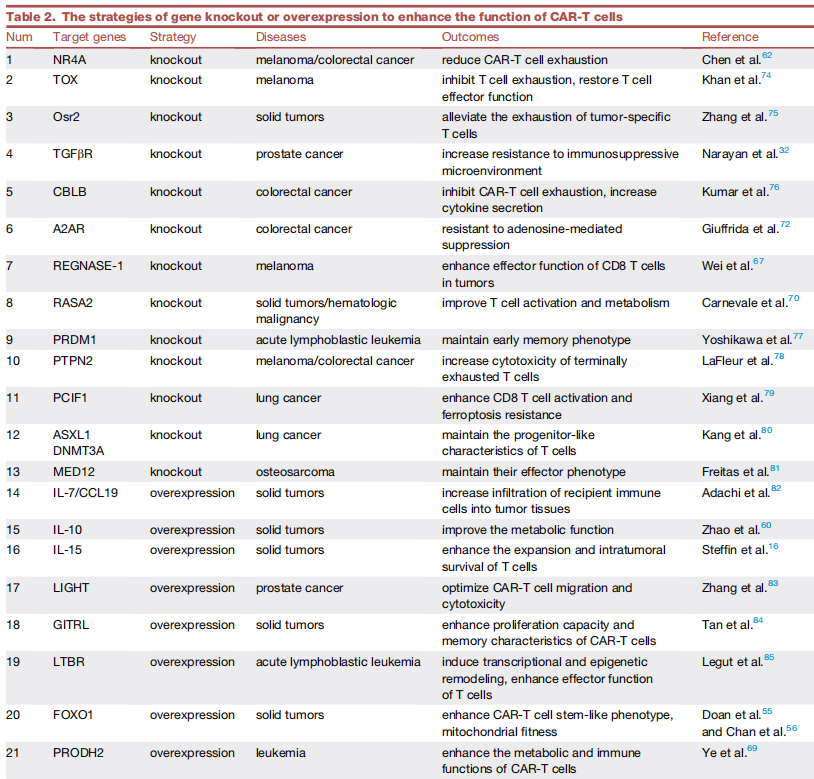
️基因敲除:NR4A、TOX、Osr2、TGFbR、CBLB、A2AR、RASA2等
️基因过表达策略:IL-7、CCL19、IL-10、IL-15、LIGHT、GITRL、FOXO1等
️小结
近年来CAR-T细胞疗法在实体瘤治疗中的临床成果取得了显著进展,但仍然需要不断探索解决目前存在的诸多挑战,虽任重道远,但未来可期!


