掺硼金刚石(BDD):一种革命性的电极材料
掺硼金刚石(Boron-Doped Diamond, BDD),亦称硼掺杂金刚石,是一种利用化学气相沉积(CVD)等技术,在合成金刚石薄膜过程中掺入硼元素而制成的先进电极材料。此材料不仅保留了金刚石本身的众多卓越性能,包括极高的硬度、出色的热导率以及优异的化学稳定性,还因硼的掺入而具备了良好的导电性和半导体特性。这种独特的组合特性,赋予了掺硼金刚石在众多高科技应用领域中极大的潜力,使其成为一种极具前景的材料选择。无论是在环境监测、能源开发还是在高端电子器件制造等领域,掺硼金刚石都展示出了其独特的优势和广泛的应用前景。
 图片来源于网络
图片来源于网络
首先,BDD具有极高的禁带宽度(约5.47 eV),远高于硅(1.1 eV)、碳化硅(4H-SiC, 3.2 eV)和氮化镓(GaN, 3.44 eV)。这一特性使其成为制造高温、高频电子器件的理想材料。其次,BDD拥有目前所有已知材料中最高的热导率,这不仅提高了器件的工作温度范围,还能显著减小器件尺寸和重量,有利于制造高性能放大器和激光器。
此外,BDD在高电场下的电子饱和速率最高,并且其空穴迁移率也是所有宽禁带半导体材料中最高的。这些特性使得BDD特别适合用于毫米波放大器和高速集成电路。同时,BDD还具备出色的电子发射能力,经过特殊处理后可以实现负的电子亲和势,成为制作冷阴极的理想选择。
不仅如此,BDD在Johnson指数、Keyes指数和Baliga指数等关键半导体性能指标上也表现优异。例如,其Johnson指数高达8200,远超4H-SiC(410)和GaN(280)。这意味着BDD在功率放大器、集成电路和开关器件等方面具有无可比拟的优势。
BDD的应用领域广泛,涵盖了平面显示、微电子、MEMS/NEMS、强电以及电化学等多个方面。特别是在电化学传感器中,BDD因其高导电性、宽电位窗口、低背景电流值和卓越的抗污染能力,成为了新一代高性能电化学传感器的理想材料。
本文将详细探讨BDD的技术背景、制备方法、物理与电学特性及其在各个领域的应用前景,旨在为大家提供全面而深入的知识,帮助大家更好地理解和认识这一革命性的材料。
️一、掺硼金刚石(BDD)的制备方法
️(一)高温高压法
展开全文高温高压法(high temperature high pressure,HPHT)是一种常用的人造金刚石合成方法。将石墨碳源以及触媒按比例进行混合后,经过高温高压处理即可得到金刚石。在此基础上,通过对石墨碳源和触媒合金进行渗硼处理或是直接将硼粉与石墨碳源以及触媒进行机械混合的方式,即可制备出 BDD 粉体。SHAKHOV等将纳米金刚石、季戊四醇以及无定形硼粉作为原料,在 7 GPa、1 230 ℃ 的条件下,保温 10 s 制备得到纳米 BDD 粉体。DUBROVINSKAIA 等将 B13C2 和石墨作为原料在 20 GPa、2 426 ℃ 和无金属触媒参与的条件下,成功制备出 BDD 块体。ZHANG 等使用 BDD 微粉,以Al–B–C 作为烧结助剂,在 1 450 ℃、5 GPa 的条件下,成功制备出 BDD 块体电极,并对亚甲基蓝模拟的印染污水进行了电化学降解试验,脱色效果高达 97%,表现出了优异的降解性能。然而,使用高温高压法制备 BDD 时,金刚石颗粒通常需要在金属溶剂的环境下析出,导致所制备得到的金刚石往往以微粉的形式存在,需进一步烧结成形才能作为电极材料使用。因此,关于高温高压法制备 BDD 电极的报道相对较少。
️(二)化学气相沉积法
化学气相沉积法(chemical vapor deposition, CVD)是将 CH4 和 H2 转变为含碳基团以及原子态氢,使其在基底材料上经过多次的吸附、解析等过程最终形成金刚石薄膜。在使用化学气相沉积制备金刚石膜的过程中,将气态硼源作为原料气体中或是在原料气体中引入挥发性的液态、固态硼源,从而实现硼元素的直接掺杂,直接在基底上形成 BDD 薄膜。化学气相沉积法所制备得到的 BDD 膜性能稳定,硼原子的掺杂浓度可控。同时,化学气相沉积技术所制备得到的 BDD 膜可直接作为膜电极使用。
ZHU 等采用 CVD 法制备得到 BDD 膜电极,对纺织污水进行降解,结果表明经过 3 h 的降解处理,污水的颜色去除率可到 100%。常见的化学气相沉积法包括热丝化学气相沉积法(hot filament chemical vapor deposition technology, HFCVD)以及微波等离子体化学气相沉积法(microwave plasma chemical vapor deposition, MPCVD)。HFCVD 是在惰性气体的保护作用下,通过加热灯丝,在高温灯丝的作用下,促使 CH4 和 H2 转变为含碳基团以及原子态氢,同时以辛硼烷或乙硼烷等气态硼化物作为硼源,最终在基底材料上得到 BDD 膜。但由于气态硼源往往具有毒性,可以通过采用硼酸三甲酯、硼酸三乙酯等液态硼源或三氧化二硼、单质硼等固态硼源进行替代。 HFCVD 具有操作方便、设备简单等优点,适用于大尺寸 BDD 膜电极的制备。但是由于灯丝温度较高,基底材料所处的温度场分布不均匀,靠近灯丝的位置温度更高,沉积速度更快,而远离灯丝的位置温度较低,沉积速度较慢,最终制备得到的膜电极厚度不均。
此外,采用的灯丝材料受热分解会使 BDD 膜受到污染。而MPCVD 则是通过微波能量将气体原料激发为等离子体,从而沉积在基底材料上形成 BDD 膜。采用 MPCVD 制备得到的 BDD 膜纯度高,性能优异。但是 MPCVD 设备价格高昂,导致其所制备的 BDD 膜电极成本也相对较高,MPCVD 多用于实验室合成 BDD 电极。因 CVD 法制备得到的 BDD 膜电极需要沉积在基底材料上,基底材料的选择同样会影响 BDD 膜电极的性能。在选取基底材料时,选取热膨胀系数与金刚石相近的材料可以避免沉积后的金刚石膜出现龟裂或剥离等现象。
此外,基底材料表面应能形成碳化物。表面碳化物的形成能够提高金刚石膜与基底材料之间的结合力,确保膜电极在使用时不会脱落,延长其使用寿命。常用的基底材料包括 Ti、 Ta、 Si 等材料,Ti、 Ta、Si 都可以与碳反应生成碳化物。Ti、Ta、Si 材料的热膨胀系数以及其碳化物的热膨胀系数如表 1 所示。
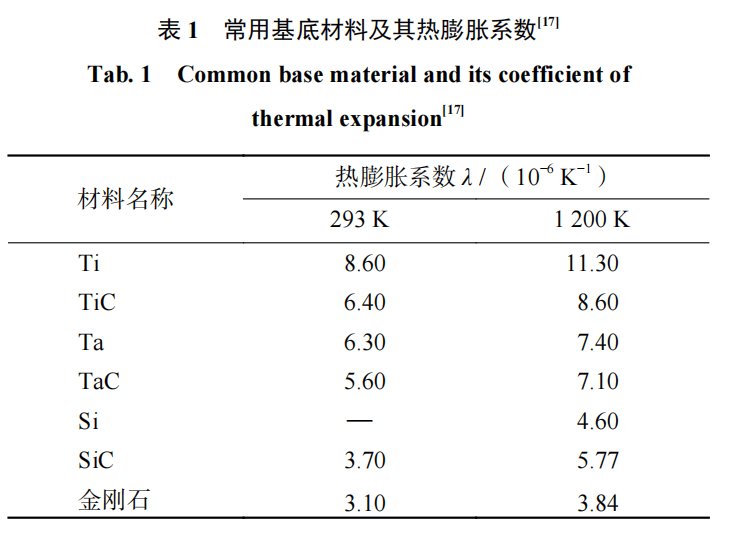 图片数据来源于参考文献
图片数据来源于参考文献
Si 具有与金刚石最为接近的热膨胀系数,但是由于 Si基底不导电,以单晶 Si 为基底材料会使 BDD 膜电极的导电性受到影响。同时,Si 是典型的脆性材料,以其作为基底会导致 BDD 膜电极具有较差的力学性能。Ta作为金属材料,具有导电性好和强度高等特点,但 Ta的价格昂贵,限制了其作为基底材料的应用。金属 Ti是比强度(强度与密度的比值)最高的材料,其密度仅为 4.5 g/cm3。以 Ti 为基底的 BDD 膜电极,不仅导电性能好,同时具有优异的力学性能以及轻质化等特点,此外,金属 Ti 价格也低于 Ta 的。因此,对于 BDD 膜电极而言,金属 Ti 是最具应用前景的基底材料。
CVD 法是目前最为常用的制备 BDD 电极的方法。关于 CVD 法制备 BDD 膜电极的研究也相对成熟。但目前 CVD 法制备 BDD 膜电极仍面临生产效率低、设备成本高等问题。同时,BDD 电极的稳定性和可靠性也同样重要。良好的制备工艺能够保证 BDD 膜电极在使用时不会出现剥离失效等现象,提高电极的稳定性与可靠性。因此,探究更为优化的 BDD 膜电极生产工艺,降低电极生产成本,将有助于促进 BDD 膜电极的商业化应用。
️二、高比表面积的掺硼金刚石电极的制备
现有的 2D-BDD 电极具有活性面积小、表面利用率低、传质速率低等缺点,限制了其降解效率,难以发挥 BDD 高效化处理的优势,而制备具有高比表面积的BDD 电极可以有效解决这一问题。目前,提高比表面积的途径有 2 种:一种是自下而上的设计方式,即通过改变基底材料形貌来获取具有特殊结构的电极材料,典型的有模板法;另一种则是自上而下的修饰方式,即通过对样品进行表面处理的方式,使得电极材料具有特殊形貌,从而达到提高比表面积的目的,以期提高电极的整体电化学性能,典型的有表面刻蚀法。
️(一)模板法
模板法是选用具有特定形貌的基底材料,利用基底材料的表面形貌,制备具有高反应活性面积的 BDD电极材料的方法。模板法的关键问题在于选择合适的基底材料。MEI 等使用泡沫钛为基底材料,制备出了具有连通大孔径的三维掺硼金刚石(three dimensional boron doped diamond, 3D-BDD)电极,不同倍数下 3D-BDD 电极内部结构 SEM 图像,如图 2 所示。
 图片来源于参考文献
图片来源于参考文献
与相同尺寸的平板电极相比,3D-BDD 电极的反应活性面积提升了 20 倍,对活性蓝(reactive blue 19)的降解效率提高了 350 倍。SUO 等将孔隙率为 80% 的泡沫镍作为基底,制备出了具有大孔径、高孔隙率的 BDD泡沫电极材料,结果发现:随着比表面积的增加,起始电位和极限扩散电流密度均得到增加,并且 BDD 的氧还原活性与比表面积大小成正比。HE 等使用网状钛金属为基底材料,制备出了网状 BDD 电极,发现:更高的表面积、传质速率和疏水表面赋予 BDD 电极优异的电化学氧化能力。选择具有连通大孔径的泡沫金属或是网状金属材料作为基底材料,不但能够提高电极材料的反应活性面积,而且连通孔径的结构会对水体的流动产生一定的影响。当含有污染物的水体流经电极的孔洞时,羟基自由基与污水进行充分反应。与二维平板电极相比,具有三维孔径结构的电极极大地改善了羟基自由基的利用率。但是,这些研究者均使用金属作为基底材料,根据 CHAPLIN 等的研究,金属材料与 BDD 薄膜的热膨胀系数差距较大,会导致基底材料与薄膜分离,进而导致复合电极材料失效,所以匹配的热膨胀系数和比表面积较大的基底材料是进一步开发自下而上的 BDD 电极制备方法的关键所在。为解决这一问题,PETRÁK 等通过旋涂法制备SiO2 纤维基底,并在其表面沉积 BDD,制备出了多孔BDD 电极。
图 3 为旋涂法的流程,流程如下:
(1)在硅基片基底上旋涂纳米金刚石颗粒作为种子层 ;
(2)(2)使用 MPCVD 反应器沉积 BDD 薄膜;
(3)(3)由 2种旋涂方式制备得到模板(图 3a 展示了在介质中旋涂纤维来制备 SiO2 纤维基底,图 3b 则展示了以糊剂刮刀涂覆来制备 SiO2 纤维基底);
(4)在模板上沉积BDD;
(5)通过 HF 去除 SiO2 纤维,增加表面积。
 图片来源于参考文献
图片来源于参考文献
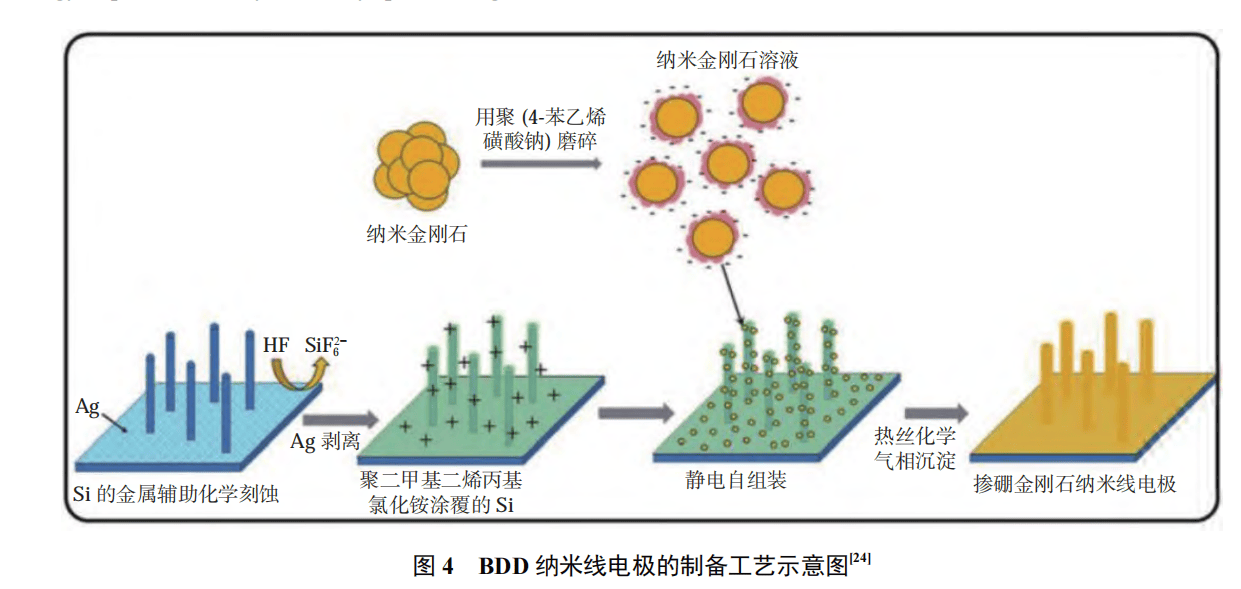
相比于选区具有特定形貌的基底材料,旋涂法简单有效,易于操作,极大地降低了基底材料的制备难度和制备成本。而且,SiO2 纤维基底与 BDD 的热膨胀系数较为接近,可以有效避免由于热膨胀系数不一致而导致的膜电极与基底材料之间的分离,为 3D-BDD 电极材料的大规模商业化应用提供了一种全新的思路。但是,相对于金属基底的 BDD 材料,使用 SiO2 纤维基底制备的 BDD 复合电极材料的导电率和机械稳定性较低。除了选用具有特定相貌的基底材料外,研究者们还通过改变基底材料的形貌,实现了对 BDD 电极材料的形貌设计。LEE 等采用金属催化硅刻蚀工艺和静电纳米金刚石播种法,在硅基底上构建纳米线形貌,从而制备出了 BDD 纳米线电极,如图 4 所示。
 图片来源于参考文献
图片来源于参考文献
具有纳米线结构的电极材料的反应活性面积提高了 3 倍,由此生成大量的羟基自由基,对甲醛和苯酚的降解效率得到大幅提高。同时,其团队还以氧化钨纳米棒为基底, 制备出了具有中空结构的 BDD 纳米棒电极材料 ,反应活性面积达到相同尺寸平板电极的 15 倍。
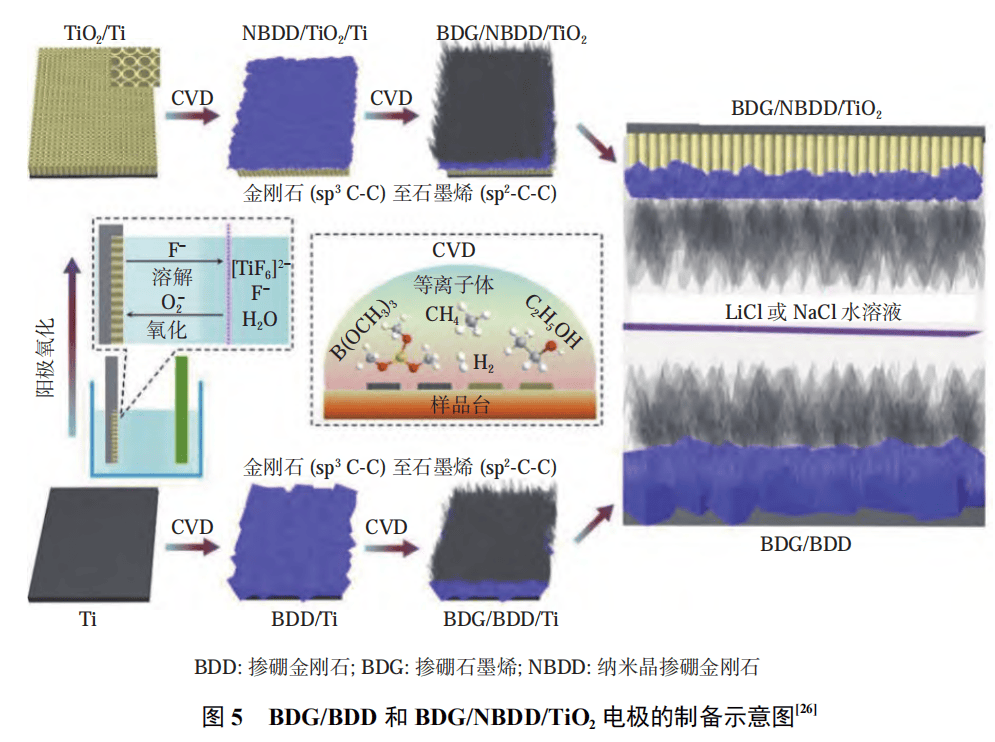
图 5 为 BDG/BDD 和 BDG/NBDD/TiO2 电极的制备示意图。YAN 等通过电化学阳极氧化法在 Ti 基底上制备 TiO2 纳米管阵列,以此作为基底材料,得到纳米晶 BDD 电极,并在电极表面负载硼掺杂石墨烯(boron doped graphene,BDG),从而制备出了 BDG/NBDD/TiO2 纳米阵列电极材料。在保证其电学性能的前提下, BDG/NBDD/TiO2 复合电极表面离子迁移速率得到提高,其电化学性能也得到了显著改善。与传统的平板电极相比,模板法增大了 BDD 电极的反应活性面积。随着反应活性面积的增大,BDD 电极能够产生的羟基自由基也随之增多,提高了电极的降解效率。同时,根据实际需求,可以选择合适尺寸和形状的模板材料,也可以对模板材料进行相应的结构设计,这为具有特殊结构的 BDD 电极材料的制备提供了一种行之有效的解决方案。然而,出于成本、使用寿命、机械稳定性、导电性等各种原因,合适的基底材料仍是 BDD 电极的规模化应用的制约因素之一。
 图片来源于参考文献
图片来源于参考文献
️(二)表面刻蚀法
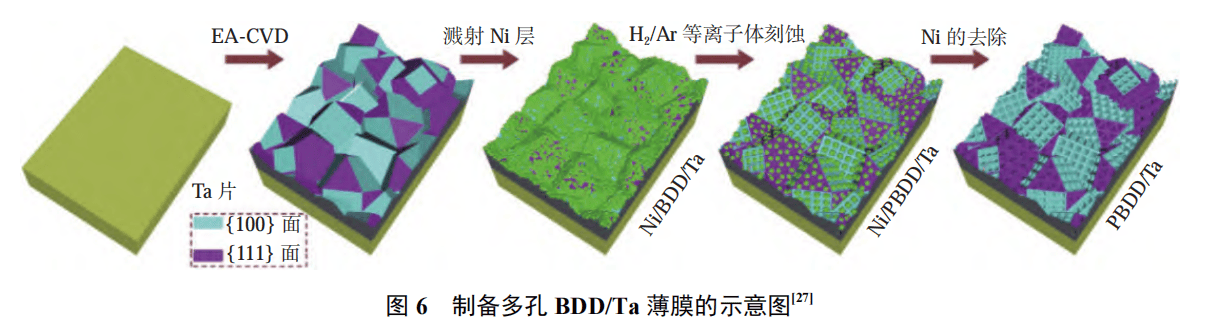
表面刻蚀也是一种增大 BDD 电极比表面积的方法。常见的刻蚀方法包括氢气等离子体刻蚀和高温刻蚀。在 BDD 表面,LI 等采用磁控溅射在 BDD 表面溅射一层金属镍(Ni)。金属 Ni 具有极高的碳溶解度,能够促进金刚石表面 C 原子与 H2 之间发生反应, 生成 CH4。利用金属 Ni 作为催化剂,采用 H2 /Ar 混合气体对 BDD/Ta 的表面进行刻蚀,制备出了具有多孔结构的 BDD 膜电极,增大了电极的反应活性面积,通过电芬顿法实现了对亚甲基蓝的快速降解。图 6 为制备多孔 BDD/Ta 薄膜的示意图,图 7 为不同刻蚀时间下Ni/BDD 薄膜的 SEM 图像。在 800 ℃ 的温度下,MIAO 等基于硼金刚石的热失重原则制备了 Si/BDD 电极,结果发现:其电化学活性反应面积增大至初始的 3.9 倍,对盐酸四环素的降解效率提升至初始的 1.73 倍 ,TOC移除率增加至 1.74 倍。
 图片来源于参考文献
图片来源于参考文献
 图片来源于参考文献
图片来源于参考文献
️(三)表面修饰处理制备掺硼金刚石电极
除了通过增大 BDD 电极的比表面积外,研究人员还通过对电极材料进行表面修饰来提高电极的电化学氧化能力。
常用的方法主要包括 2 种 :
(1)通过在BDD 膜电极表面负载过渡金属氧化物的方式构建复合电极。常用的过渡金属氧化物包括 PdO2、SnO2、MnO2等。这类金属氧化物具有析氧过电位高、催化活性较强等特点。在通电时,BDD 与过渡金属氧化物均会产生羟基自由基,从而实现降解效率的提升。但过渡金属氧化物的引入会造成复合电极导电性降低,造成一部分电流损耗。
(2)通过在 BDD 电极表面构建 p-n 结结构来提高电极性能。通常以 BDD 膜电极作为 p型半导体,TiO2 作为 n 型半导体材料。由于 TiO2 还具有光催化特性,TiO2 /BDD 复合电极往往具有光电协同特性,能够更好地对污水实现降解。 ZHUO 等将 PdO2 和 SnO2 前驱体溶液涂覆在BDD 电极表面,制备出了纳米 SnO2 修饰的 BDD 复合电极材料,以及纳米 PbO2 修饰的BDD复合电极。图 8 为 BDD 复合电极的 SEM 图。如图 8 所示:将 F 原子引入 SnO2 晶格中,可有效减小 SnO2 粒径,与 BDD 电极相比,BDD/SnO2–F 的析氧过电位增加了0.13 V。同时,在 氯 化 聚 氟 醚 磺 酸 盐( F –53B) 的 降 解 实 验 中 ,BDD/SnO2– F 电极的降解速率比 BDD 电极的提高了15.07%,明显提升了降解效率。
 图片来源于参考文献
图片来源于参考文献
席耀辉等通过水热法在 BDD 表面负载棒状纳米 TiO2,制备出了具有 p –n 结效应的复合电极。图 9 为 n–TiO2 /p–BDD 异质结和光生载流子的转移过程的示意能带图 ,其中:vac 表示真空度,χ 表示电子亲和势,EF 表示费米能级,VB 表示价带,CB 表示导带,h 为普朗克常量,v 为光的频率。从图 9 中可以看出:在紫外光的照射下,TiO2 半导体可以产生光生载流子(电子和空穴),p–BDD 导带中的电子向 n–TiO2 导带中转移,n–TiO2 价带中的空穴向 p–BDD 价带转移,在空间电荷区内部的静电势有利于光生载流子的分离,从而使电子–空穴复合率显著降低,而与电子、空穴相关的氧化还原反应过程会持续发生,促进有机污染物在电极表面的高效降解。另外,金刚石和 TiO2的禁带宽度分别达到 5.47 eV 和 0.50 eV,电子亲和势分别达到3.2~3.4 eV 和 4.3 eV。在 n–TiO2 /p–BDD异质结结构中,基底材料禁带宽度大,电子亲和势小的特性可以促进电子从 p–BDD 的导带向 n–TiO2 导带运动,进而提高 TiO2的光催化活性。同时,使用 TiO2 /BDD 复合电极对亚甲基蓝模拟的染料污水进行了降解试验,在通电和光照作用下,30 min 即可达到 100% 的降解效果。与BDD 电极相比,降解效率提高 20% 在 TiO2 /BDD 复合电极的基础上,马玉祥借鉴光催化领域重用的电子传输 Z 型机制,构建 TiO2 /Au/BDD 体系,其电子转移方式如图 10 所示。在 TiO2 /Au/BDD复合电极中,Au 作为电子传输媒介,使得 TiO2 与 BDD之间的接触电阻大大降低,形成欧姆接触。TiO2 的导带(CB)中的电子(e −)通过 Au 层可以直接与 BDD 的价带(VB)中的空穴(h +)复合。TiO2 /Au/BDD 的这种三元结构有利于 TiO2 和 BDD 内部的 e −、h +分离和传输,减少内部载流子的复合机会。BDD 内 CB 上的e−和 TiO2 内 VB 上的 h +被更多地保留下来,用于氧化还原反应中,从而电极的催化性能得到极大提高。因此,与其他电极相比,TiO2 /Au/BDD–30 电极具有更好的催化效果。相比于使用 PdO2 和 SnO2 等析氧过电位高的材料,TiO2 与 BDD 的复合会降低复合电极的电化学势窗和析氧过电位,p–n 异质结的形成会进一步提高体系的反应速率,同时使复合电极拥有光催化氧化的能力。
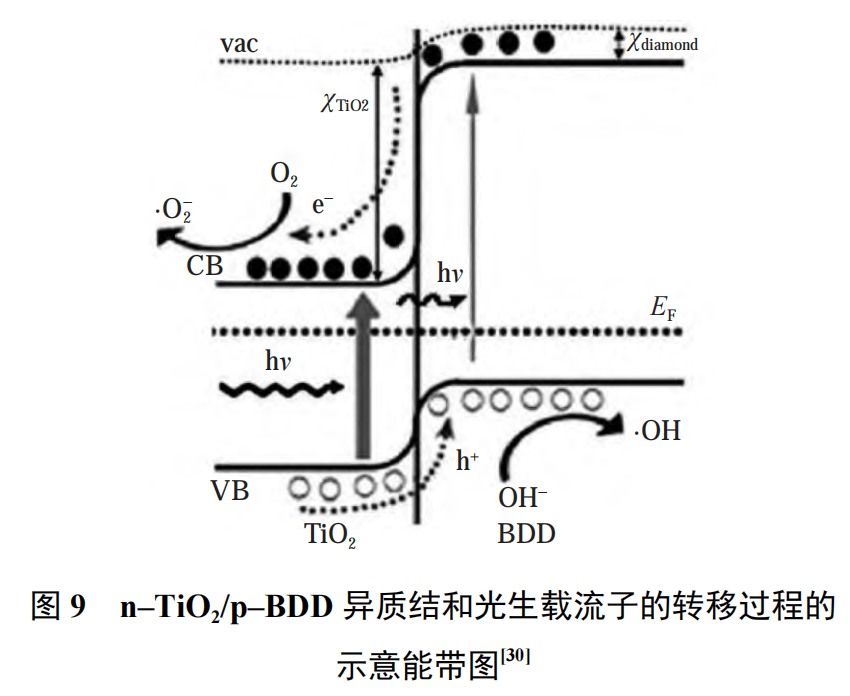 图片来源于参考文献
图片来源于参考文献
 图片来源于参考文献
图片来源于参考文献
️三、蓝钻芯BDD电极
蓝钻芯材料相较于目前大多数BDD材料的制备,具有更严苛的工艺流程及质量标准,是BDD中的佼佼者。“蓝钻芯”凭借其出色的综合性能,不仅在价值和品质上能够媲美天然蓝钻,更是在材料科学领域树立了新的标杆。作为材料界的王者,蓝钻芯展现出一系列令人赞叹的卓越特性:其半导体材料的禁带宽度高达5.5eV,处于行业领先水平;其超宽的电化学窗口更是铂金的 2 倍,展现出超强的电化学活性;此外,在室温条件下,它的导热系数是铜的5倍,具备极为出色的导热能力;而在硬度方面,蓝钻芯是刚玉的10倍,表现出极高的耐磨性。除此之外,该材料还具备出色的耐腐蚀性、抗辐射能力和良好的生物相容性等多重优势,使其成为众多高科技应用的理想选择。
 图11 DEPOSON德百顺蓝钻芯电极俯视图和截面图
图11 DEPOSON德百顺蓝钻芯电极俯视图和截面图
此外,经过十余年的潜心研发与技术积累,DEPOSON已掌握超大面积人造蓝钻芯生长技术以及纳米晶成核技术,使得蓝钻芯材料具有纳米颗粒的尺寸效应、表面效应、量子效应和界面效应等,在力学、电学、光学等方面表现出了常规材料不具备的性能。另外,蓝钻芯还具有高强度、良好的韧性和延展性,并能够起到显著的增强和增韧作用,同时其表面光滑,摩擦系数小,这些特性使得它在大功率高频芯片、传感器、电极材料等诸多领域有着得天独厚的应用优势。
 Bluamec蓝钻芯材料(BDD电极材料)
Bluamec蓝钻芯材料(BDD电极材料)
另外,受限于电极材料,一般的电解只能从水中分解出氢气和氧气,而蓝钻芯作为超级电极,运用的是上述“电化学应用”的方式,和其超宽的电化学窗口,可以将水分子(H2O)瞬间电解并轻松的重构出️OH0(羟基自由基)、️O3(三氧)、️O0(氧原子)、H2(氢气)和O2(氧气)--Bluamec水分子重构技术。这一技术在氧端与氢端相关的领域中得到有效的应用。如氧端的️OH0、️O3、️O0,这些因子均具有很强的氧化性,我们称之为“蓝钻富氧因子”,其作用是利用其强氧化性与细菌细胞壁中的脂类双键发生反应,渗透到细菌内部,作用于蛋白质和脂多糖,改变细胞的通透性,导致细菌死亡,也就是具有广谱杀菌能力,其次蓝钻富氧因子还能够氧化分解产生臭味的物质,如氨、甲硫醇、硫化氢等,将其转化为无害的成分,如CO2、H2O等,从而消除异味。除了杀菌、除味,蓝钻富氧因子还具有祛果蔬农残、食物保鲜等作用。尤为可贵的是,在圆满完成消毒除味去农残等使命之后,蓝钻富氧因子会分解为水和氧气,不会在物品表面残留丝毫痕迹,且安全无毒无有害副产物,这一特性是所有化学添加类消毒除味产品皆难以企及的。
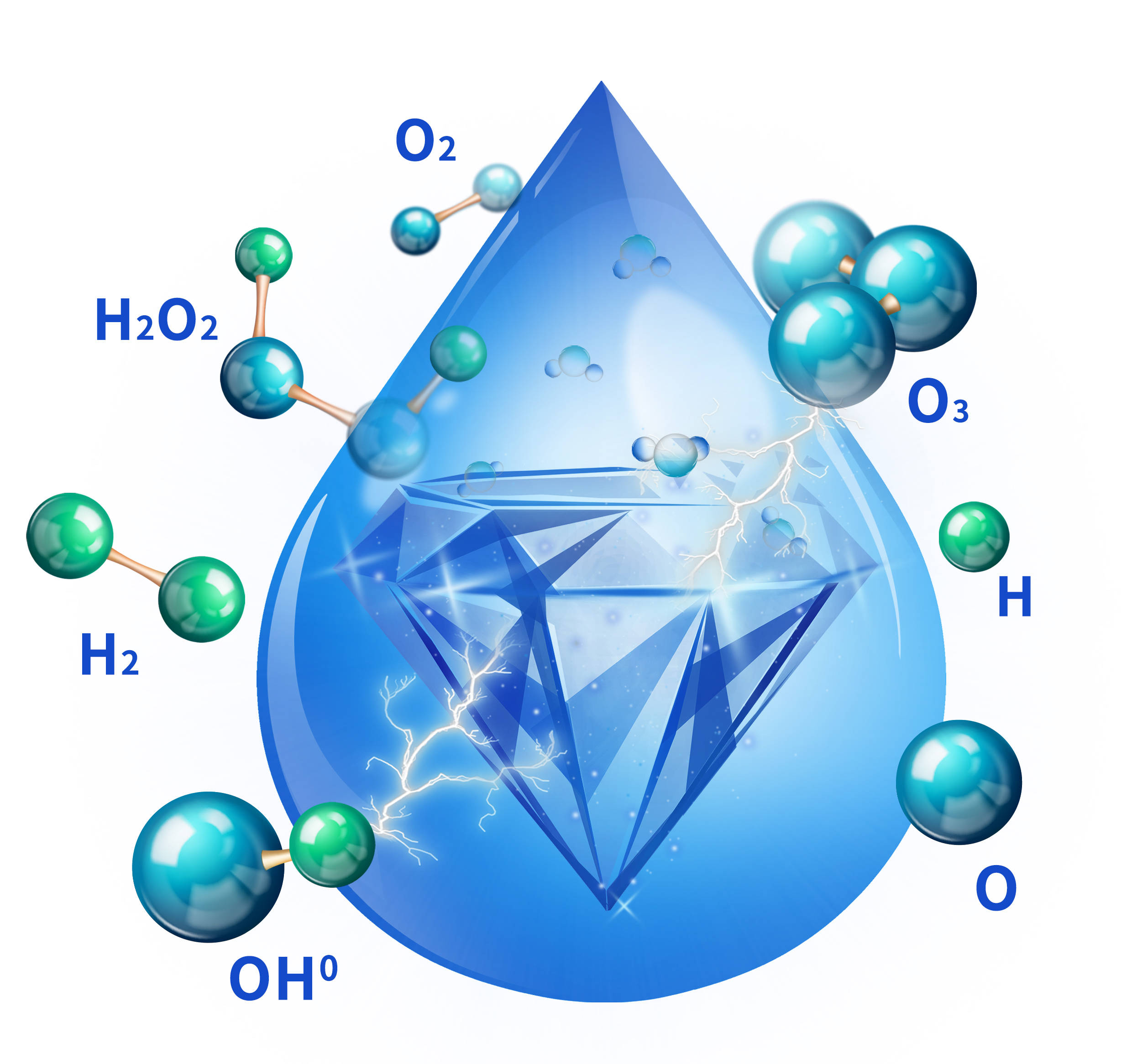 Bluamec蓝钻水分子重构技术图
Bluamec蓝钻水分子重构技术图
特别强调的是,OH0的氧化还原电位是2.80V,仅次于氟(F)的2.87V、O3的氧化还原电位是2.07V,想要在水中电解出诸如OH0、O3这类高ORP的物质,对电极材料本体的抗氧化特性有着极为严苛的要求,哪怕尊贵如铂金也难以胜任。而蓝钻芯本身就是最耐氧化的材料,能够在严苛的工作环境中长时间保持稳定高效的运行。
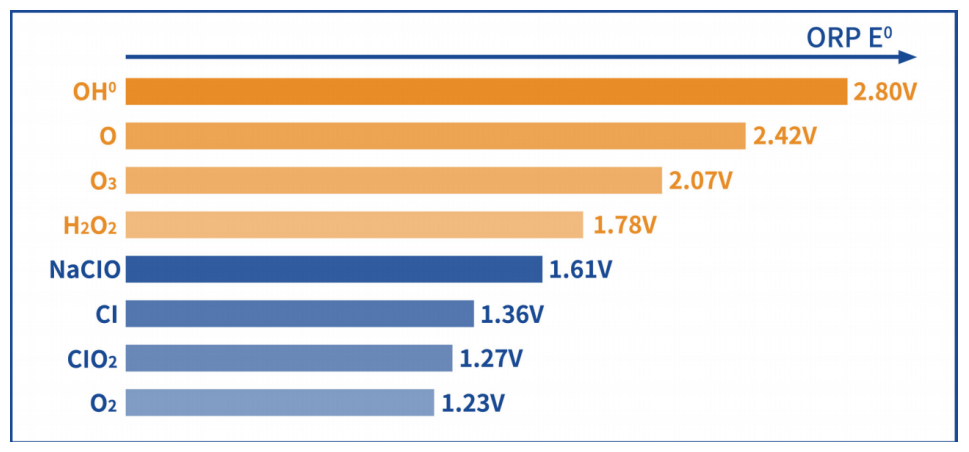 氧化还原电位图
氧化还原电位图
掺硼金刚石(BDD)作为一种革命性的电极材料,凭借其优异的物理和电学特性,展现出广泛的应用潜力。通过高温高压法和化学气相沉积法等先进制备技术,BDD不仅继承了金刚石的高硬度和化学惰性,还通过硼掺杂实现了良好的导电性和半导体特性。这些独特的优势使得BDD在高温、高频电子器件、功率放大器、电化学传感器等领域具有重要的应用价值。
随着对BDD制备技术的不断研究和优化,特别是高比表面积电极的开发,未来的BDD电极材料将更加高效、稳定,能够满足日益增长的工业需求。此外,蓝钻芯等新型材料的出现,更是为BDD的应用开辟了新的方向,推动了其在环保、杀菌和食品保鲜等领域的创新应用。
总之,掺硼金刚石的研究与应用正处于快速发展之中,未来有望在多个高科技领域发挥更大的作用。通过不断的技术进步和材料创新,BDD将为我们带来更为高效、环保的解决方案,推动相关产业的可持续发展。
️参考文献:
李莲莲, 陈冠钦,高性能掺硼金刚石电极的研究进展,[J].金刚石与磨料磨具工程
2022年10月第5期第42卷,543-551.


